近日,我校材料科學與工程學院新材料研究院劉磊、馮永海團隊在Science子刊《科學進展》(Science Advances)上在線發表研究論文“Nitrite reductase–mimicking catalysis temporally regulating nitric oxide concentration gradient adaptive for antibacterial therapy”。江蘇大學為第一完成單位,馮永海副研究員為第一作者,劉磊研究員為最后通訊作者,南京醫科大學附屬常州二院王亮亮博士、中國科學技術大學附屬第一醫院楊甜柯博士為共同通訊作者。
感染部位的細菌群落是由多種細菌和獨特的代謝微環境組成的復雜系統,其特征包括局部溫度升高、高反應性氧化物種(ROS)、特定酶類和營養缺乏。復雜的感染微環境(IME)通常需要復雜的抗菌材料設計,以適應IME并增強抗菌治療。簡化設計同時提高IME適應性仍然是一個巨大的挑戰。受亞硝酸鹽還原酶催化的啟發,團隊設計了一種智能銅亞硝酸鹽還原酶(CuNIR)模擬物,通過簡單的NO濃度梯度時間調控策略,同時高效殺菌并促進組織修復。這種設計在初始催化階段產生高濃度的NO,確保其抗菌效果,同時在后期階段持續釋放低濃度的NO,有助于促進組織修復。
在本研究中,團隊通過生物礦化構建了一種CuNIR模擬物(溶菌酶自組裝納米纖維/CuS納米雜化物,NFLA/CuS NHs),該模擬物能夠催化亞硝酸鹽生成NO,其中超小CuS納米顆粒作為活性中心,而NFLA作為具有輔因子作用的骨架。研究揭示了CuNIR模擬物增強的催化活性與其特定結構之間的密切關系,NFLA表面暴露的超小CuS簇和Cu原子結構以及NFLA在模仿CuNIR固有活性中的特定輔因子效應(如對抗壞血酸的良好親和性)在速率決定步驟中的重要性。研究表明,以上兩個因素協同作用,共同增強了催化活性。
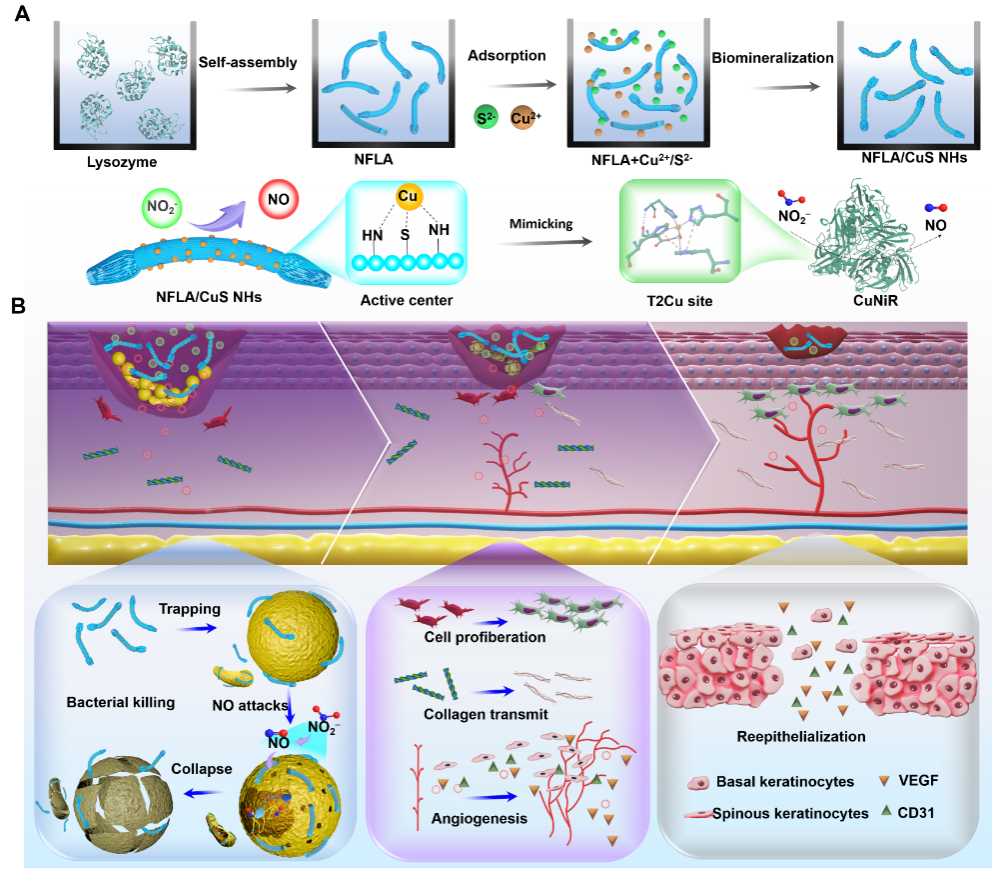
NFLA/CuS NHs動態調控NO釋放策略適應IME的抗菌治療。其固有的細菌結合能力、CuNIR模擬活性和近紅外響應性,使NFLA/CuS NHs在初始催化階段(0.5小時)能夠在細菌周圍產生大量NO,這會導致細胞膜崩解和變形,同時引發包括氨基酸和蛋白質合成損傷、毒素產生和細胞分裂在內的細胞內干擾,最終導致細菌死亡和抗菌耐藥性降低。隨后,通過NFLA/CuS NHs介導的亞硝酸鹽還原釋放的低濃度NO顯著促進了細胞遷移和血管生成,同時抑制炎癥并促進新生血管形成和膠原沉積。這種通過亞硝酸鹽還原酶模擬催化實現的NO濃度梯度時間調控最終有助于慢性感染傷口的修復。
該研究成果得到了國家自然科學基金項目和江蘇省自然科學基金項目的資助。(材料學院)
文章鏈接:https://www.science.org/doi/10.1126/sciadv.adp5935